Enzimas
:max_bytes(150000):strip_icc()/illustration-of-a-restriction-enzyme-restriction-enzymes-also-known-as-restriction-endonucleases-are-enzymes-that-cut-a-dna-molecule-at-a-particular-place-578457799-5728e5b85f9b589e34c5d5c2.jpg)
As enzimas realizam quase todas as milhares de reações químicas que ocorrem nas células.Um detalhe é que elas fazem isso dezena até centena de vezes mais rápidas. Elas também ajudam na formação de novas moléculas, lendo as informações genéticas armazenadas no DNA.
As enzimas possuem diversas funções, aplicações farmacológicas e importância clínica; tentarei dar uma explanada em tudo isso!
Funções:
São proteínas especiais com a capacidade de catalisar reações. Portanto, são catalisadores orgânicos. Dessa forma, aumentam a velocidade das reações diminuindo a energia de ativação das mesmas. A vida não seria possível sem as enzimas! Quando a enzima fica "velha", ela é degradada, metabolizada, eliminada e substituída por outra enzima que o ribossomo irá sintetizar.
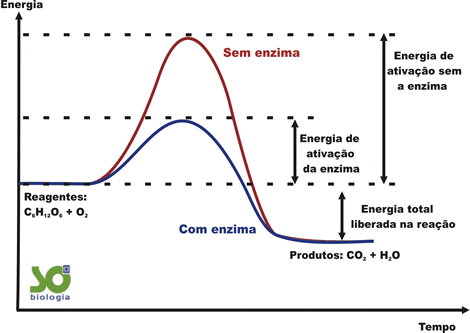
Propriedades importantes:
Não são consumidas durante as reações que participam. Podem catalisar a mesma reação por diversas vezes. Possuem tempo de vida útil (não duram para sempre). São renovadas pelas células. Possuem quantidade limitada dentro das células. Possuem alta especificidade com seus substratos.
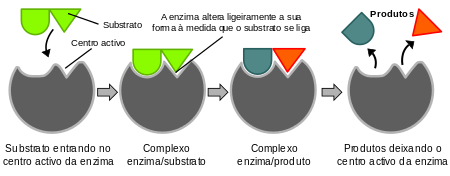
A importância da forma:
As enzimas só passam a funcionar quando adquirem sua forma tridimensional perfeita, a chamada estrutura terciária.
> Cada enzima possui sua forma própria, o que gera especificidade com seus substratos.
> A região mais importante da enzima é o chamado sitio ativo ou sítio de ligação, onde é apresentado o formato ideal para se ligar com seu substrato.
>O que acontece se a forma tridimensional da enzima é modificada?
ELA SOFRE PREJUÍZO NA SUA FUNÇÃO!! A mudança na forma da enzima é chamada desnaturação! Essa alteração REDUZ a sua AFINIDADE pelo substrato! Torna a ligação de ambos dificultada, lentificando a reação!
Vamos aprofundar um pouco!
ATIVANDO ENZIMAS;
Algumas enzimas são produzidas pela célula na sua forma inativa.
Estas formas inativas são chamadas de apoenzimas.
• Elas serão ativadas por coenzimas ou cofatores, tornando-se completa, passando a ser denominada de Holoenzima.
• Cofatores – substâncias inorgânicas. Ex: Fe, Zn, Mg, Ca.
O ferro, por exemplo, é o cofator da hemoglobina. Ela só funciona se tiver ele, para se ligar com o oxigênio, por exemplo. Já o cálcio é o cofator de várias enzimas da coagulação, que, também, só funcionam se tiver o cálcio presente.
• Coenzimas – substâncias orgânicas. Ex: Vitaminas.
Todas vitaminas, exceto a vitamina D, são coenzimas. A vitamina K, por exemplo, é coenzima necessária para enzimas que produzem fatores de coagulação funcionarem. Sua falta favorece casos hemorrágicos. Já a vitamina C é coenzima na formação de colágeno.
OBS: Os cofatores e coenzimas mudam um pouquinho a forma da enzima, como está na própria imagem.
VUDU: sem os cofatores ou coenzimas as enzimas NÃO funcionam!
É POR ISSO QUE NÃO PODE FALTAR VITAMINA NO ORGANISMO! Se não as reações não acontecem!
Exemplo: coagulação sanguínea
DINÂMICA DAS REAÇÕES ENZIMÁTICAS;
Vamos ver agora quais são os fatores que podem alterar a velocidade das reações catalisadas por enzimas.
• Concentração de substrato.
• Quantidade de enzimas.
• Tamanho do sistema de reações.
• Temperatura do meio.
• pH do meio.
• Presença de inibidores. (fármacos, agrotóxicos, toxinas de animais e de plantas etc)
• Presença de cofatores ou coenzimas
| velocidade da reação em função do seu substrato |
Observe: chega um momento, na primeira imagem, que por mais que se ofereça mais substrato a velocidade da reação não é alterada!
O QUE É O KM? É A CONSTANTE DE MICHAELIS!
PRA QUE SERVE O KM?
• Ele nos diz o grau de afinidade que uma enzima possui com seu substrato!
• Na última foto a cima as duas enzimas possuem a glicose como substrato.
• A hexoquinase tem um Km menor do que a glicoquinase.
• Isso significa que: A hexoquinase possui mais afinidade com a glicose do que a glicoquinase.
Sabemos isso pelo processo mental que fizemos através do gráfico, mas isso que é a constante de michaelis! Muito mais fácil, né?
Obs: O que faz uma enzima ter mais afinidade por uma substância do que outras é ter a forma mais ideal para o substrato! No final, tudo se resume na forma!

SE LIGA:
A temperatura ótima é a temperatura na qual a enzima terá sua forma ideal e consequentemente a velocidade máxima da reação.
• Se aquecermos demais a função é comprometida pois a enzima vai DESNATURAR!
• Se resfriarmos a função é comprometida pois a agitação molecular é menor, sendo mais difícil a enzima encontrar seus reagentes ao acaso.
VUDU: pra desnaturar com temperatura é apenas aquecendo!
Esse é o perigo da febre! Quando uma pessoa está com, por exemplo, 40 graus de febre, muitas proteínas estão sendo desnaturadas. Isso dificulta, processos metabólicos, como a digestão, e, principalmente, dificulta a ação de enzimas neuronais. Por isso que, em febres muito alta, a pessoa pode delirar, ou entrar em convulsão (muito comum em crianças).
Quanto mais a proteína aguentar ficar em temperaturas altas mais ligações entre suas cadeias ela tem, principalmente bissulfeto, que é mais forte que a ligação de hidrogênio. Ou seja, tem mais aminoácidos como a cisteína e a metionina, por exemplo, pois essas possuem enxofre para fazer as ligações dissulfeto.
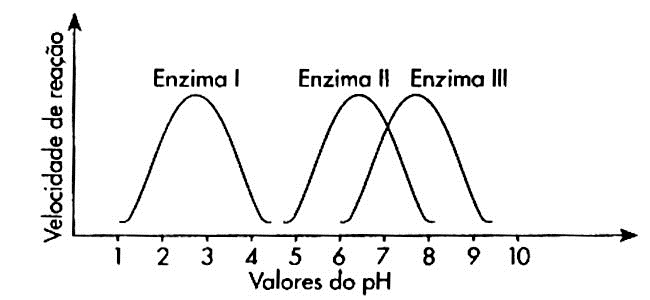
Toda enzima possui seu pH ótimo, onde apresenta sua forma perfeita e a velocidade de reação é máxima!
• Variando o pH pra mais (alcalose) ou pra menos (acidose) a enzima vai sofrer DESNATURAÇÃO!!
• É diferente do processo da temperatura ok?
Na temperatura só desnatura com o aquecimento, aqui no pH, qualquer alteração vai desnaturar!

VENDO A IMAGEM, QUAL ENZIMA RESISTE MELHOR A VARIAÇÃO DE PH?
A tripsina!!! Por apresentar mais ligações intramoleculares do tipo bissulfeto.
BORA APROFUNDAR!
• Inibidores enzimáticos;
São substâncias que podem ser endógenas ou exógenas, e, obviamente, possuem a capacidade de inibir a reação. Existem basicamente dois tipos de inibidores: os competitivos e os não competitivos, também chamados alostéricos.
O inibidor pode inibir se ligando a o sitio ativo da enzima, e dessa forma ela não consegue se ligar ao substrato. Pode inibir também mudando a forma da enzima, se ligando em qualquer parte da enzima e ela acaba desnaturando, pouco ou muito.
Alguns fármacos, por exemplo, a fim de emagrecimento, inibe a lipase pancreática. Alguns inibem enzima que fazem produção de colesterol, e são usado para tratar colesterol alto, etc.
Inibição Competitiva;
São aqueles, como já dito, que se ligam ao sitio ativo da enzima, competindo com o substrato original da enzima. Vamos as considerações importantes então;
• O processo é realizado pela presença de um inibidor competitivo (IC) que irá atuar da seguinte forma, então:
O IC possui uma forma semelhante ao substrato original.
• O IC COMPETE pelo sítio ativo da enzima com o substrato original.
• O IC quando se liga a enzima NÃO inativa a mesma.
• Depois de um certo tempo, ele se desprende da enzima e ela continua atuando
Quanto mais IC em relação ao [S], mais a reação estará inibida.
• Quanto menos IC em relação ao [S], menos a reação estará inibida.
• Mesmo com a presença do IC as enzimas continuam funcionando.
• Logo, se tivermos uma proporção muito maior de [S] em relação ao IC, é possível chegarmos a velocidade máxima da enzima mesmo com o IC presente.
O IC pode fazer ligações de hidrogênio, ou seja, ele terá uma constante de dissociação alta e facilmente se desprenderá da enzima. Mas se ele fizer ligação covalente, isso ocorre em alguns casos, como na inibição não competitiva, ele não se solta mais.
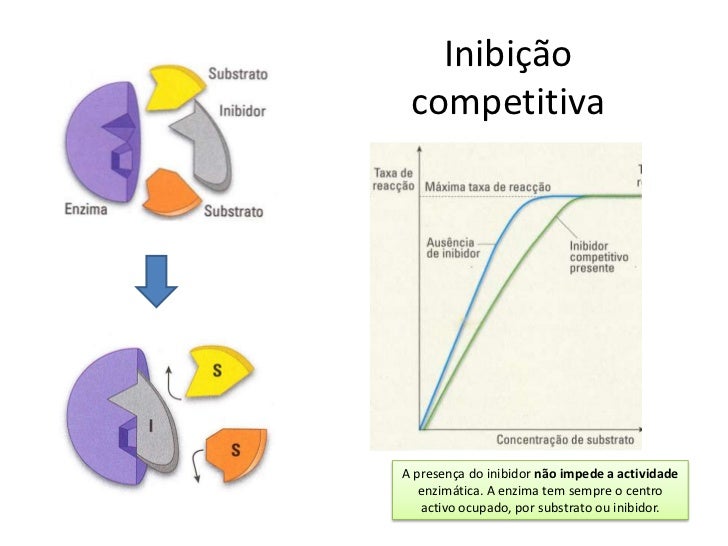
GRÁFICO: VR X [S] + PRESENÇA DE IC

Inibição não competitiva (Alostérica);
• O inibidor não competitivo (INC) se liga numa região da enzima chamada sítio alostérico. Diferente do IC, ele NÃO se liga no sítio ativo da enzima.
• Ao se ligar no sítio alostérico, o INC ALTERA a forma da enzima, impedindo sua ligação com o substrato original [S].
• Logo, a presença do INC INATIVA a enzima por alterar sua forma.
• Não adianta colocar mais [S] gente, a enzima está inibida com o INC!!!
• Com a presença do INC, as enzimas que são ligadas a ele não funcionarão mais.
• Se outras enzimas continuarem livres, sem INC, elas continuam funcionando normalmente.
• Logo, não será possível alcançar a velocidade máxima da reação, mesmo que se coloque mais [S] no ambiente.
Essa inibição é aquele tipo que eu falei acima, do tipo ligação covalente, que como se liga em outro sitio sem ser o ativo, desnatura a proteína!
Vamos para a nossa amada clínica e sair desse vudu de inibição!
Caso Clínico:
Paciente masculino, 30 anos, vem para consulta na endocrinologia pela primeira vez!
QP: quero perder peso.
HDA: Paciente afirma estar acima do peso e incomodado com a estética, já tentou diversas dietas e planos de treinamento, mas devido a sua rotina de trabalho não conseguiu manter uma rotina de atividade física e dieta adequada.
História Familiar: Mãe e pai obesos, hipertensos e diabéticos, avó falecida de infarto do miocárdio, irmão acima do peso e irmã saudável.
H.Social: paciente afirma comer muita fritura, não gosta de salada, come muita carne vermelha, alimentos industrializados e geralmente quando chega em casa janta alimentos congelados.
EXAME FÍSICO:
• Antropometria: altura – 1,75m - Peso: 102Kg
• IMC: 33.3 (obesidade grau I). Circunferência abdominal: 102 cm
• Paciente se apresenta bem, percebo manchas de aspecto amarelado em pálpebra superior (xantelasma), sem demais alterações que chame atenção.
• Cardio: PA: 150/100, FC=90bpm, ritmo regular sem sopros.
• Pulmão: ausculta normal.
• Abdome: globoso, flácido, sem massas e com peristalse normal.
• Membros I: um pouco edemaciados, pulsos presentes e sincronizados.
CONDUTA:
• Solicitamos:
• Hemograma
• Perfil lipídico
• Função renal
• Eletrólitos
• Dosagem de TSH, T4, cortisol e testosterona.
• Encaminhamos:
• Consulta com nutricionista e educador físico.
• Prescrevemos fármacos antihipertensivos
• Remarcamos a consulta para o próximo mês.
RESULTADOS DOS EXAMES:
• Hemograma normal.
• Eletrólitos normais
• HDL: 30 (ideal acima de 40)
• LDL: 170 (ideal abaixo de 100)
• Triglicerídeos: 500
• Hormônios normais.
NOVA CONDUTA:
• Prescrevemos atorvastatina 1x ao dia
• Prescrevemos orlistat 1 comprimido antes do almoço e do jantar e recomendamos que não aumente a ingestão de gorduras, mesmo se perder peso! Informamos que o paciente pode ter alteração nas fezes após tomar o medicamento, onde estas podem sair mais volumosas, com coloração mais amarelada e odor piorado.
• Reforçamos a importância do acompanhamento nutricional e do educador físico.
• Retornar em 3 meses.
EXPLICAÇÃO:
A atorvastatina é um tipo de fármaco da classe das estatinas, estas atuam inibindo a enzima HMG-CoA redutase, responsável pela produção de colesterol no fígado, tendo como seu reagente direto a substância HMG-CoA. Com base no gráfico de ação das estatinas indique qual o tipo de inibição que estas provocam na produção de colesterol.

• As estatinas são inibidores competitivos, pois como vimos no gráfico, aumentando a concentração do seu subtrato, podemos alcançar a velocidade máxima da reação, sendo assim as enzimas produtoras de colesterol continuam ativas, um perfil típico da inibição competitiva.
• O orlistat, por ser um inibidor competitivo da lipase pancreática, reduz a digestão e absorção das gorduras. Sabemos que as vitaminas lipossolúveis (KADE) são absorvidas juntamente com a gordura da dieta, como esse processo está prejudicado, o indivíduo pode apresentar menor absorção delas e redução dos níveis dessas vitaminas no corpo.
Estudo de aprofundamento: Aplicação de enzimas
